Sebelum belajar kalian menonton video dibawah ini dulu ya....
Perhatikan contoh soal berikut ini!
Perhatikan contoh soal berikut ini!
Kalian menjawab soal prites terlebih dahulu ya...
Atom merupakan bagian terkecil dari unsur, sehingga dapat disimpulkan bahwa sifat suatu unsur ditentukan oleh keadaan dari atom-atom penyusun unsur tersebut. Atom tersusun dari inti atom (proton dan neutron) yang dikelilingi oleh elektron. Unsur-unsur dalam satu golongan mempunyai elektron valensi yang sama, sedangkan unsur-unsur dalam satu periode mempunyai elektron valensi yang menghuni kulit yang sama. Maka sifat-sifat unsur mempunyai hubungan dengan konfigurasi elektron, dimana unsur-unsur dengan konfigurasi elektron yang mirip akan mempunyai sifat yang mirip. Sifat-sifat yang terlihat dalam tabel periodik unsur yaitu:
1. Jari-jari Atom
Jari-jari atom merupakan jarak dari pusat atom (inti atom) sampai kulit elektron terluar yang ditempati elektron dan menunjukkan ukuran suatu atom.
Panjang pendeknya jari-jari atom ditentukan oleh 2 faktor, yaitu:
1) Jumlah kulit elektron
Semakin banyak jumlah kulit yang dimiliki oleh suatu atom, maka jari-jari atomnya makin panjang.
2) Muatan inti atom
Bila jumlah kulit dari dua atom sama banyak, maka yang berpengaruh terhadap panjangnya jari-jari atom adalah muatan inti atom. Semakin besar muatan intinya, gaya tarik inti atom terhadap elektron lebih kuat sehingga semakin pendek jari-jari atomnya.
Berikut gambar dan tabel ukuran atom dalam Tabel Periodik Unsur:
Dari gambar dan tabel tersebut, terlihat bahwa:
- Dalam satu golongan semakin ke bawah, periode( jumlah kulit) bertambah, meskipun dalam hal ini jumlah muatan inti semakin banyak tetapi pengaruh bertambahnya jumlah kulit lebih besar daripada pengaruh muatan inti. Akibatnya jarak elektron kulit terluar terhadap inti makin jauh (panjang).
- Dalam satu periode semakin ke kanan, jumlah kulit elektronnya tetap tetapi muatan inti (nomor atom) dan jumlah elektron pada kulit semakin bertambah. Akibatnya, gaya tarik inti terhadap elektron terluar semakin kuat sehingga menyebabkan jarak elektron kulit terluar dengan inti semakin dekat (pendek).
2. Energi Ionisasi
Energi ionisasi adalah energi minimum yang diperlukan atom netral dalam wujud gas untuk melepas suatu elektron paling luar (yang terikat paling lemah) membentuk ion positif. Semakin mudah melepas elektron, maka energi ionisasi semakin kecil. Sebaliknya semakin sukar elektron terlepas dari atom, maka semakin besar energi ionisasinya,
Energi ionisasi pertama atom unsur-unsur golongan utama dapat dilihat pada tabel:
Hubungan energi ionisasi dengan nomor atom unsur-unsur digambarkan pada grafik:
Dari tabel dan grafik tersebut terlihat bahwa:
- Dalam satu golongan semakin kebawah, jari-jari atom semakin besar (elektron valensinya semakin jauh dari inti), akibatnya elektron valensinya semakin mudah dilepas.
- Dalam satu periode dari kiri ke kanan cenderung mencapai kestabilan (mempunyai 8 elektron valensi). Golongan I,II, dan III cenderung melepaskan elektron sedangkan golongan V,VI, dan VII cenderung menerima elektron.
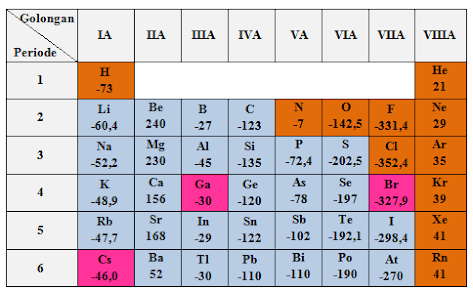
3. Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dihasilkan atau dilepaskan apabila suatu atom menarik sebuah elektron. Afinitas elektron dapat digunakan sebagai ukuran mudah tidaknya suatu atom menangkap elektron. Semakin besar energi yang dilepas (afinitas elektron) menunjukkan bahwa atom tersebut cenderung menarik elektron dan menjadi ion negatif.
Berikut merupakan gambar dan grafik afinitas elektron beberapa unsur:
Berdasarkan tabel dan grafik diatas, terlihat bahwa:
- Dalam satu golongan, muatan inti bertambah positif, jari-jari atom makin besar, dan gaya tarik inti terhadap elektron yang ditangkap makin lemah, akibatnya afinitas elektron berkurang.
- Dalam satu periode, muatan inti bertambah positif sedangkan jumlah kulit tetap menyebabkan gaya tarik inti terhadap elektron yang ditangkap makin kuat, akibatnya afinitas elektron cenderung bertambah.
Perhatikan contoh soal berikut ini!
4. Keelektronegatifan
Keelektronegatifan atau elektronegatifitas adalah kecenderungan suatu atom dalam menarik pasangan elektron yang digunakan bersama dalam membentuk ikatan. Harga keelektronegatifan bersifat relatif (berupa harga perbandingan suatu atom terhadap atom yang lain).
Berikut merupakan gambar data skala kuantitatif menurut Pauling :
Semakin besar harga keelektronegatifan suatu atom, semakin mudah bagi atom tersebut untuk menarik pasangan elektron ikatan, atau gaya tarik elektron dari atom tersebut semakin kuat. Dengan demikian, pola kecenderungannya akan sama dengan afinitas elektron.
Keelektronegatifan mempunyai makna yang berlawanan degan energi ionisasi, sebab semakin mudah suatu atom melepaskan elektron berarti semakin sukar dalam menarik elektron, dan sebaliknya. Skala keelektronegatifan tidak mempunyai satuan sebab harga ini didasarkan kepada gaya tarik suatu atom pada elektron, relatif terhadap gaya tarik atom lainnya pada elektron.
Perhatikan contoh soal berikut ini!
Sekarang coba kerjakan soal berikut pada buku kalian masing-masing dengan mengikuti semua contoh soal diatas!
Untuk menguji kemampuan kalian, silahkan jawab pertanyaan postes berikut ini ya...
Setelah mengerjakan postes, kalian jangan lupa mengisi respon kalian dalam menggunakan media ini ya,,,
Untuk link nya ada dibawah ya,,,
















Tidak ada komentar:
Posting Komentar